第21章 - 熵与热力学第三定律
I. 宏观熵
回顾一下,熵 S 是一个描述无序度的状态函数。这意味着两个状态之间的熵变与路径无关,仅取决于起点和终点。到目前为止,我们将宏观熵变 ΔS 表示为可逆热流除以温度的积分:
ΔS=∫Tδqrev↔dS=Tδqrev(1)
我们可以使用这个表达式和热力学第一定律,来推导其他用热容表示的 ΔS 的有用表达式:
对于恒容(等容)过程:
ΔS=∫T1T2TnCˉV(T)dT(2)
为了推导这个公式,我们从 ΔS=∫Tδqrev 和第一定律:dU=δq+δw 开始。由于 δw=−Pext dV 且在恒容条件下 dV=0,所以不做功,我们的表达式简化为 dU=δq。我们也知道 dU=CV(T)dT (或 dU=nCˉV(T)dT,其中 CˉV(T) 是摩尔热容),这使得我们可以将恒容下的部分热流写为 qV=CV(T)dT=nCˉV(T)dT。使用我们的宏观熵表达式,恒容下的 ΔS 变为:
ΔS=∫TδqV=∫TdU=∫T1T2TnCˉV(T)dT
对于恒压(等压)过程:
ΔS=∫T1T2TnCˉP(T)dT(3)
类似地,对于恒压过程,我们有 δqP=nCˉP(T)dT。ΔS 变为:
ΔS=∫TδqP=∫T1T2TnCˉP(T)dT
III. 绝对熵与热力学第三定律
到目前为止,我们一直关注系统的熵变 ΔS。使用方程3并令 T1=0,我们可以写出绝对熵的表达式:
S(T2)=S(0K)+ΔS; 例如 S(T2)=S(0K)+∫0T2TCP(T)dT(12)
我们可以将绝对熵看作是将物质从 0 K 开始,将所有使物质达到 T2 的相关过程(升温、相变)的 ΔS 加和起来。定义了绝对熵之后,我们就可以定义热力学第三定律了。
热力学第三定律指出,一个系统的熵 S 是有限的正值,并且一个完美晶体物质在 0 K 时的熵为 0。这是合理的:一个完美晶体系统只有一种排列方式,所以 S=kBlnW=kBln(1)=0。此外,对数函数永远不会是负数,因此根据定义 S=kBlnW,熵必须总是正值或零(在完美晶体的情况下)。
我们规定系统必须是“一个完美晶体物质”,是因为有些系统在 0 K 时存在一些熵,例如玻璃、一氧化碳以及包含不同晶体排列的系统。实际上,非晶体系统的绝对熵仍然非常小。因此,我们仍然可以近似认为:
S(0K)=0(13)
相变的熵
与焓类似,熵可以通过相变在给定温度下增加。
ΔtrsS=Ttrsqrev(14)
相变是可逆过程的一个很好的例子。这是因为温度的任何微小变化都会引起相变的发生。
ΔtrsH=qP(15)
因此,相变的熵与该相变的焓相关。
ΔtrsS=TtrsΔtrsH(16)
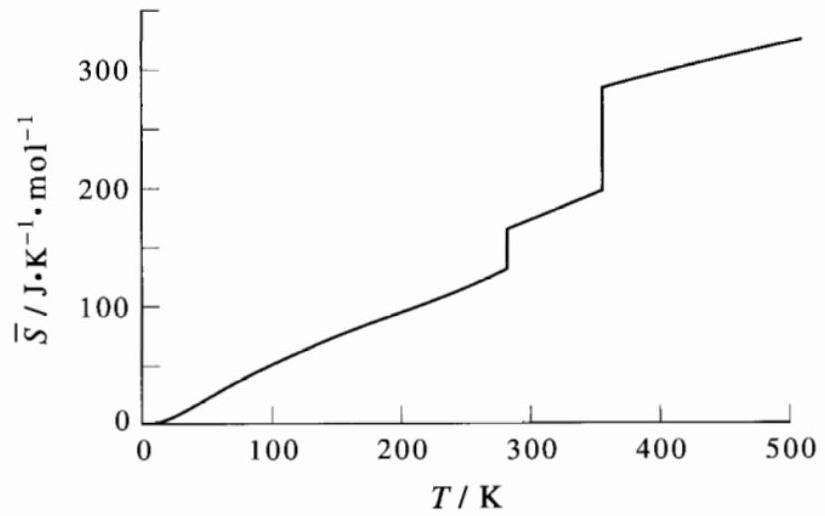
熵是一个状态函数。为了计算一种物质在任意温度下的绝对熵,我们必须将升温和相变引起的熵变相加。对于一种气体:
ΔS(T)=∫0Tfus TCP(T)dT+Tfus Δfus H+∫Tfus Tvap TCP(T)dT+Tvap Δvap H+∫Tvap T1TCP(T)dT(17)
图 21.1
氮的摩尔熵随温度(从 0 K 到 400 K)变化的曲线图。
与焓类似,我们可以使用标准摩尔熵来计算一个反应的熵变。对于以下通式反应,
aA+bB→yY+zZ(18)
该反应的熵变为:
ΔrS∘=yS∘[Y]+zS∘[Z]−aS∘[A]−bS∘[B](19)
最后,有一些普遍趋势需要记住:
- 气体的标准摩尔熵大于固体。
- 质量增加会增加热无序度,因此标准摩尔熵也增加。
- 分子越大,标准摩尔熵越大。
- 越“松软”的分子(柔性分子)具有越大的标准摩尔熵。
- 储存在分子间作用力中的能量越多,标准摩尔熵越大。”
